
|
BD Biosciences Pharmingen がモノクローナル抗体やタンパク質の標識に使用している蛍光色素の吸収・蛍光スペクトルを紹介いたします。このうち4種類の蛍光色素、 fluorescein isothiocyanate (FITC)、R-phycoerythrin (R-PE)、BD-Cy-Chrome™(PE-Cy5™)、PerCP は、488 nm の光を放つアルゴンイオンレーザーを備えたシングルレーザーフローサイトメーターでの3カラー解析にご利用いただけます(図 1)。
BD Biosciences Pharmingen では、allophycocyanin (APC)標識のモノクローナル抗体や、Texas Red™ 標識のアビジンもご用意しております。どちらの色素も、デュアルレーザー機能を備えたフローサイトメーターでのマルチカラー解析実験に最適です(図 1)。APCは633 nm のヘリウムネオン(HeNe)レーザー、647 nm のクリプトンレーザー、550-650 nm に調節可能なダイレーザーで、励起させることができます。(ダイレーザーのレーザーメディウムはパンプレーザー、通常はイオンレーザーで励起される蛍光色素溶液です。)アビジンを標識しているTexas Red™ は568 nmのアルゴン-クリプトン混合ガスレーザー、もしくはAPCとTexas Red™ が併用可能なダイレーザーで励起させることができます。様々なレーザーや検出器、フィルター、蛍光色素の組み合わせがマルチカラー解析に使用できますので、各色素が必ず1種類の検出器で検出されるようご注意ください(例えばバンドパスフィルターや、ダイクロックミラー、ロングパスフィルターなど)。弊社の試薬をお使いいただく際に最適な機器設定を下記にご案内いたします(表 1もご参照ください)。 Allophycocyanin (APC) は、緑藻類が持つ光合成補助色素です。分子量は約105 KDaです。APCはR-PEの発色団であるphycoerythrobilinに似た構造のphycocyanobilin発色団を1分子当り6つ備えています。APCの最大吸収波長は650 nm(図 2)、最大蛍光波長は660 nm です(図 2)。この蛍光色素の検出には、660 ± 10 nm バンドパスフィルターの使用が最適です。APCはデュアルレーザーを備えたフローサイトメーターでのマルチカラー解析にご利用いただけます(図 2)。600-640 nm のレーザー光で励起可能です。ご使用の際には633 nm のHe-Ne レーザーか、600-640 nm に調節可能なダイレーザーをお薦めいたします。 BD Cy-Chrome™(PE-Cy 5™) は、R-phycoerythrin と cyanine色素(分子量 1.5 KDa)を組み合わせた、最大吸収波長約650 nm (図 2)のタンデム標識システムです。488 nm で励起させると、励起状態の蛍光色素(R-PE)が蛍光エネルギーをcyanineに伝達し、最大蛍光波長約670 nmで発光します(図 2)。この色素の検出には650-nmロングパスフィルターが最適です。図 2に見られるように、2つの蛍光色素間のエネルギー伝達効率は優れており、R-PEによる575nmの蛍光の5%以下しか失われません。フローサイトメトリーに用いられる他の蛍光エネルギー伝達システム(例: RED613™、ECD、PerCP)と比べると、BD Cy-Chrome™ は、高い蛍光強度と広いスペクトルを有しているため3カラー解析用として非常に優れた蛍光色素です。当社のR-PE標識と同様に、各抗体もしくはタンパク質にBD Cy-Chrome™(PE-Cy5™)が1分子結合します。BD Cy-Chrome™(PE-Cy5™)は広い吸収領域を持つためこの色素を両方のレーザーが励起してしまう,デュアルレーザー搭載のフローサイトメーターでのご使用はお薦めいたしません。 Fluorescein isothiocyanate (FITC) は分子量389 ダルトン、最大吸収波長495 nmの蛍光色素です(図 2)。488 nmで励起すると、520 nm前後(or 近辺)の波長で最大の蛍光を発します(図 2)。530 ± 15 nm バンドパス (BP) フィルターがこの蛍光色素の検出には最適です。Isothiocyanate 変異体(FITC)が抗体やタンパク質の標識にもっともよく使われていますが、他の変異体もございます。FITCは高い量子収量(吸収から発光までのエネルギー伝達効率)を持つため、吸収された光子の約半分が蛍光として発光されます。標識物質(抗体、アビジン、ストレプトアビジンなど)には通常3から5分子のFITCが標識されます。 R-phycoerythrin (R-PE) は赤藻類に見られる光合成補助色素です。In vivoでは、R-PE は光合成中にクロロフィルに光エネルギーを伝達します。In vitroでは、R-PE は1分子当り34のphycoerythrobilin蛍光色素を有する240-kDaのタンパク質です。R-PE は1分子当り多数の蛍光分子を有するためフローサイトメトリーのアプリケーションに最適な色素です。最大吸収波長は564 nmで、488 nmで励起すると、最大蛍光波長は約575 nmです(図 2)。シングルレーザーフローサイトメーターでの検出には、585 ± 21 nm バンドパス フィルターのご使用をお薦めいたします(図 1)。デュアルレーザーシステムを用いてマルチカラー解析を行う場合には、他の標識(例: Texas Red™)とのコンペンセーションを行うために、より狭い検出枠(or幅or領域)が必要となります。このために575 ± 13-nm バンドパス フィルターをお薦めいたします(図 1)。弊社の抗体やタンパク質は1分子につき、R-PEが約1分子標識されています。PEの蛍光は、fluorescence-2(FL2)チャンネルで検出します。 PE-Texas Red™ はR-PEとTexas Red™を組み合わせたタンデム標識システムで、最大吸収波長は約564 nmです。488-nmで励起すると、励起した蛍光色素(PE)が蛍光エネルギーをTexas Red™分子に伝達し、Texas Red™が最大蛍光波長約615 nmで発光します。R-PEと一緒にPE-Texas Red™標識を使用する場合には、この二種類の蛍光色素の発光プロファイルがかなり重なるため、特に注意が必要となります。 Peridinin chlorophyll protein (PerCP) は渦鞭藻類、Glenodiniumに見られる光合成器官の一部です。PerCPは分子量約35 KDaの複合タンパク質です。488 nmのアルゴンレーザーで励起すると、PerCPの最大励起波長は約490 nm、最大蛍光スペクトルは約675 nmです。蛍光の検出にはFluorescence-3 (FL3) チャンネルを利用します。光退色(フォトブリーチング)しやすいため、PerCP標識はstream-in-air フローサイトメーターでの使用にはお勧めいたしません。 PerCP-Cy5.5 は、PerCPとcyanine色素(Cy5.5™)を組み合わせたタンデム標識システムで、最大吸収波長は約490 nmです。488 nmで励起すると、励起された蛍光色素(PerCP)が蛍光エネルギーをcyanine分子に伝達し、cyanine分子がより長い波長で発光します。その結果、最大蛍光波長は約694 nmになります。この色素の検出には650 nm ロングパスフィルターが最適です。蛍光の検出にはFluorescence-3 (FL3) チャンネルを利用します。PerCP-Cy5.5はstream-in-air フローサイトメーターでのご使用にお勧めいたします。 APC-Cy7 は、APCとcyanine色素(Cy7™)を組み合わせたタンデム標識システムで、最大吸収波長は約650 nmです。ダイレーザーまたはHeNeレーザーで励起すると、励起された蛍光色素(APC)が蛍光エネルギーをcyanine分子に伝達し、 cyanine分子がより長い波長で発光します。最大蛍光波長は約767 nmです。この蛍光色素の検出には、Hammatsu R3896 PMTのようなred-sensitive検出器と共に750 nm ロングパスフィルターのご使用をお薦めいたします。APC-Cy7をAPCと併用する場合には、特別なフィルターが必要となります。PharRed標識、およびPharRed染色された細胞においては、可視光による長期露出から蛍光色素を守るため、特別な注意が必要となります。 Texas Red™ は、sulforhodamine 101のsulfonyl chloride変異体で、分子量は625 ダルトンです。BD Biosciences Pharmingenでは、Texas Red™標識のアビジンをマルチカラー解析の二次試薬としてお薦めしております。Texas Red™は赤色領域の長波長側で発光するため(図 2)、FITCとスペクトルがほとんど重なりません。Texas Red™とR-PEを含むマルチカラー解析には、PE検出器への“漏れこみ”を避けるため、調節可能なダイレーザーを備えたデュアルレーザーフローサイトメーターでTexas Red™を励起することをお薦めいたします。568 nmのkryptonレーザーを使用すると、レーザー光がR-PEチャンネルに漏れこんでしまいます。ダイレーザーの595-605 nm領域で両蛍光色素を励起する場合、Texas Red™はAPCと併用してマルチカラー解析にご使用いただけます。Texas Red™の最大吸収波長は596 nm、595-600 nmで励起した場合の最大蛍光波長は615 nmです(図 2)。この色素の検出には620 ± 10-nm バンドパスフィルターの使用をお薦めいたします(図 1)。 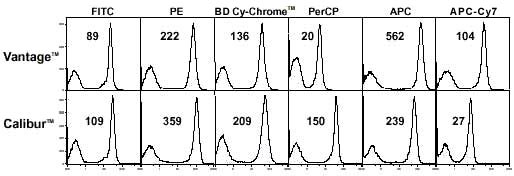
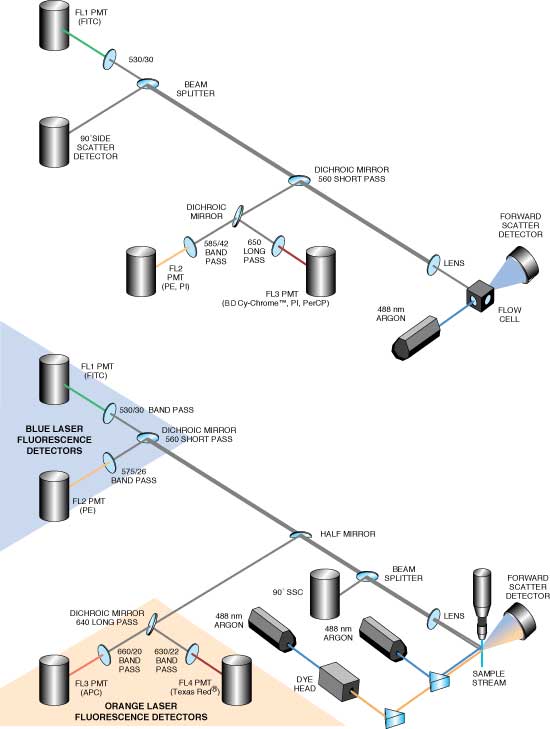
図1 2つの検出器が光散乱を検出し、3つのphoto-multiplier tubes (PMTs) が蛍光シグナルを検出します。バンドパスフィルターは、BD Biosciences Pharmingen の蛍光色素:FITC、PE、BD Cy-Chrome™(PE-Cy5™)、Becton DickinsonのPerCPの検出に最適になるよう設定されています。 “概略図下”デュアルレーザーフローサイトメーターでの6パラメータ検出 2つの検出器が散乱光を検出し、4つのPMTsが蛍光シグナルを検出します。バンドパスフィルターは、BD Biosciences Pharmingen の蛍光色素:FITC、PE、APC、Texas Red™の検出に最適なよう設定されています。第二レーザー(オレンジ)は、rhodamine 6 Gを励起用蛍光色素として使用する調節可能なdye headから発光されます。前方光散乱(FSC)、側方光散乱(SSC)、FITC、PEシグナルはすべて第一の488-nmアルゴンイオンレーザーによって励起されます。APCとTexas Red™シグナルは、2本目のレーザー(488-nmアルゴンイオンレーザーのdye head)によって産出されます。 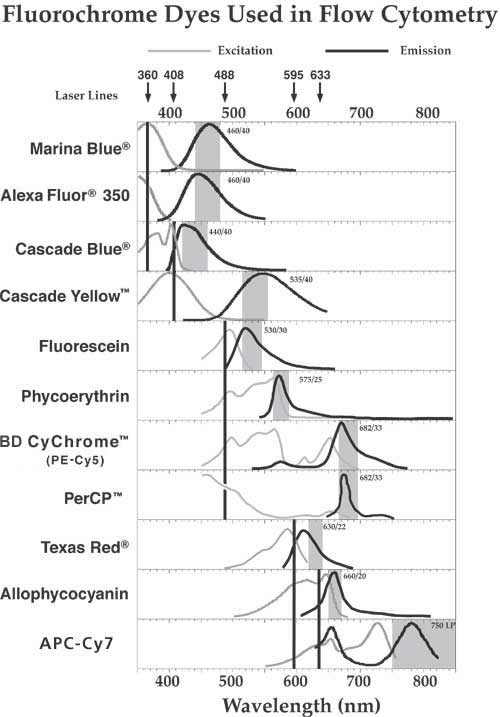
図 2. 蛍光色素の吸収スペクトル 表 フローサイトメーターと色素の組み合わせ
References
* Loken, M.R., 1990. Immunofluorescence Techniques in Flow Cytometry and Sorting, 2nd Ed., Wiley. pp 341-353.
* Parks, D., L. Herzenberg, and L. Herzenberg. 1989. Flow cytometry and fluorescence-activated cell sorting. Fundamental Immunology, Second Edition. William Paul, Ed.Raven Press, Ltd, New York.
* Zola, H. 1995. Detection of cytokine receptors by flow cytometry. In Current Protocols in Immunology (J. Coligan, A. Kruisbeek, D. Margulies, E. Shevach, W. Strober, eds.) John Wiley and Sons, New York. Unit 6.21.
* Immunofluorescence and cell sorting. In Current Protocols in Immunology. (J. Coligan, A. Kruisbeek, D. Margulies, E. Shevach, W. Strober, eds) John Wiley and Sons, New York. Unit 5.1 - 5.6.5. Shapiro, H.M. 1988. Practical Flow Cytometry, 2nd Ed. Wiley-Liss, New York.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||